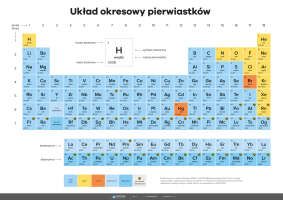
Układ Okresowy Pierwiastków to fundamentalna koncepcja w chemii, która umożliwia organizację i klasyfikację pierwiastków chemicznych w sposób logiczny i uporządkowany. Pierwsze próby stworzenia takiego systemu datują się na początki XIX wieku, kiedy to naukowcy zaczęli odkrywać coraz więcej pierwiastków i postulowali istnienie jakiegoś porządku w ich właściwościach chemicznych.
Pierwsze kroki
Układ Okresowy w swojej pierwotnej formie został zaproponowany przez rosyjskiego chemika Dmitrija Mendelejewa w 1869 roku. W swojej tabeli Mendelejew uporządkował pierwiastki według ich wzrastającej masy atomowej, zachowując jednocześnie podobne właściwości chemiczne w tej samej kolumnie. Odkrycie Mendelejewa wielokrotnie udoskonalane było przez innych naukowców, ale struktura pierwiastków w układzie okresowym jest w dużej mierze oparta na jego oryginalnych koncepcjach.
Budowa układu okresowego
Obecnie Układ Okresowy składa się z 118 znanych pierwiastków, uporządkowanych według swojej liczby atomowej. Pierwiastki są umieszczone w kolejnych wierszach, nazywanych okresami, tak aby pierwiastki o podobnych właściwościach chemicznych były umieszczone w tej samej kolumnie, zwanej grupą. W ten sposób można łatwo zidentyfikować wzory, podobieństwa i trendy w zachowaniu się pierwiastków w różnych reakcjach chemicznych.
Pierwiastki i ich właściwości
Każdy pierwiastek w Układzie Okresowym ma swoje oznaczenie chemiczne, które jest reprezentowane przez jeden lub dwa symbole chemiczne. Symbole te pochodzą z łacińskich lub greckich nazw pierwiastków, na przykład H dla wodoru, O dla tlenu, czy Fe dla żelaza. Oprócz symboli chemicznych, każdy pierwiastek ma również swoją liczbę atomową, masową i grupę.
Podobieństwo grup i okresów
Najbardziej charakterystyczną cechą Układu Okresowego jest fakt, że pierwiastki umieszczone w tej samej kolumnie – grupie, mają podobne właściwości chemiczne. Na przykład, pierwiastki z pierwszej grupy, zwanej alkalicznymi, są bardzo reaktywne i łatwo oddają swoje jednoelektronowe konfiguracje elektronowe. Z drugiej strony, pierwiastki z grupy szesnastej, zwanej chalcogenami, mają tendencję do tworzenia związków chemicznych z metalem, co prowadzi do powstawania minerałów takich jak siarka czy tlenek siarki.
Porządkowanie pierwiastków
Kluczowym elementem Układu Okresowego jest fakt, że pierwiastki są uporządkowane według swojej liczby atomowej. Liczba atomowa to liczba protonów znajdujących się w jądrze atomowym, a zatem jest to unikalna cecha każdego pierwiastka. Dzięki temu uporządkowaniu możemy łatwo zidentyfikować i porównywać pierwiastki na podstawie ich właściwości.
Zastosowanie układu okresowego
Układ Okresowy jest niezwykle przydatny w chemii i naukach pokrewnych. Dzięki niemu możemy przewidywać zachowanie się pierwiastków w różnych warunkach i reakcjach. Układ ten ma także ogromne znaczenie w kontekście projektowania i syntezy nowych związków chemicznych, a także w dziedzinach takich jak fizyka jądrowa czy nauki o materiałach.
Wniosek
Układ Okresowy to jedno z najważniejszych narzędzi w chemii, które pomaga nam zrozumieć i klasyfikować pierwiastki chemiczne. Jego budowa opiera się na koncepcjach Mendelejewa i umożliwia przewidywanie ich właściwości na podstawie uporządkowania w tabeli. Dzięki temu możemy lepiej poznać i wykorzystać świat pierwiastków w szerokim zakresie dziedzin nauki i przemysłu.